PPI(Proton Pump Inhibitor)のリスク・ベネフィット
(※スライド資料をざっと文字に書き起こしたので誤字脱字など悪しからず…。)
[PPIの有効性]
胃酸分泌は、アセチルコリン、ガストリン、ヒスタミンの3つの刺激によって調節されており、これらの受容体が刺激されることでプロトンポンプが活性化され、胃酸分泌が促進される。したがって、こうした受容体を阻害する薬剤は胃酸分泌を抑制する。
PPI(Proton Pump Inhibitor)は直接プロトンポンプを阻害する薬剤である。そのため、利用可能な胃酸分泌の最も強力な阻害剤であるといわれている。
内視鏡検査で確認された逆流性食道炎既往のある患者175人(オメプラゾールを4~8週投与して治癒した患者)を対象としたランダム化比較試験[1]によれば、寛解はラニチジンにくらべてオメプラゾールで優れていることが示されている。
この研究では被験者を5群(シサプリド10㎎1日3回、ラニジチン150㎎1日2回、オメプラゾール20㎎1日1回、ラニチジン+シサプリド、オメプラゾール+シサプリド)にランダム化し、12か月の治療を行いっている。そして、その5群で寛解(内視鏡による食道病変なしの割合)を比較した結果、オメプラゾールはシサプリド、ラニチジンに比べて、またオメプラゾール+シサプリドは、ラニチジン+シサプリドに比べて有意に寛解が多いという結果であった。
いくつかのランダム化比較試験では、低用量アスピリン使用時におけるPPI併用は消化性潰瘍リスクを低下させることが示されている。2015年に報告されたメタ分析[2]によれは、PPI併用「あり」は「なし」と比較して、統計的にも有意に消化性潰瘍(RR 0.27, 95% CI 0.17-0.42)、消化管出血(RR 0.50, 95% CI 0.32-0.80)を低下させている。また、低用量アスピリン使用時のPPI併用はH2受容体拮抗薬に比べても消化管イベントが少ないことがランダム化比較試験9研究のメタ分析[3]で示されている。(オッズ比0.28[95%信頼区間0.16~0.50])
ワルファリン投与中は消化管出血リスクが増加する可能性がある。特にNSAIDsとワルファリンを併用している患者においては消化管出血リスクが増加するかもしれない。2016年に報告された後ろ向きコホート研究[4]によれば、PPIの併用で、ワルファリン関連の上部消化管出血リスクが低下することが示されている。(調整ハザード比0.76[95%信頼区間0.63~0.91])特にNSAIDsや抗血小板薬を服用している人でリスク減少が示されている。
このように優れた有効性を持つ薬剤ではあるが、その不適切使用も多いという指摘がある。PPIは米国で最も多く処方される薬剤の一つだが、25-70%は適切な適応ではないといわれている。[5] また、欧州ではPPI処方の40-60%が不適切処方で、適切な胃腸疾患診断なしに処方されている。[6] さらにPPIの処方期間が長期漫然使用となっており、それは小児でも同様の傾向であるという指摘もある。[7][8]
PPIは長期漫然使用されるケースも多く、こうした使用実態から有害事象に関する報告も多い。(図1) 報告されている多くの薬物有害事象は、胃酸分泌の抑制作用に起因するものと考えられる。ビタミン・ミネラルの吸収阻害、胃酸減少による感染防御機能の低下などが代表的なものだろう。心血管疾患リスクの増加はクロピドグレルとの相互作用の文脈の中で論じられることが多い。間質性腎炎はPPI以外の薬剤でも起こりえる。
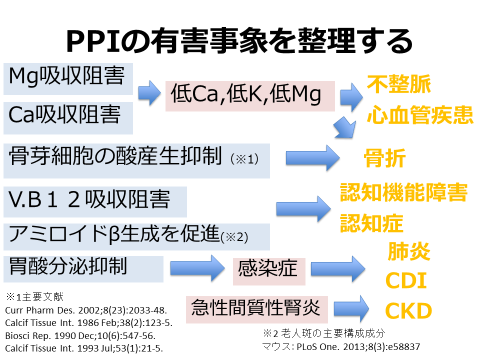
(図1)PPIの有害事象を整理する
2014年に報告された症例対照研究[9]によればPPIの使用で低Mg血症による入院リスクが1.43倍増加することが示されている。特に利尿薬使用者でリスクが増加したと報告されている。
particularly increased among patients receiving diuretics, (adjusted odds ratio, 1.73; 95% CI 1.11-2.70)
not significant among patients not receiving diuretics (adjusted odds ratio, 1.25; 95% CI 0.81-1.91).
利尿薬を併用していると低Mg血症のリスクが高くなるかもしれないという研究結果は2015年にも報告されている。このコホート研究[10]では、ループ利尿薬併用者では7倍ものリスク増加を示した。(図2)

2013年に報告された症例対照研究[11]によれば、PPIの使用タイミングに関わらず、ビタミンB12欠乏症の有意な増加が認められている。VB12が欠乏すると認知機能障害や貧血などが起こりえると考えられる。後述のPPIと認知症リスクの関連は、こうしたVB12の欠乏がそのメカニズムとして挙げられている。
[PPIと骨折リスク]
PPIはカルシウムの吸収阻害を起こす他、骨芽細胞の酸産生抑制することで、骨代謝に異常をもたらすのではない可と考えられている。2006年にJAMA報告された症例対照研究(PMID:17190895)ではPPIの服用期間が長いほど大腿骨頸部骨折リスクが上昇した。(図3)

(図3)PPIと骨折リスク
PPIの使用と骨粗鬆症性骨折の関連を検討した、2008年の症例対照研究[12]でも、使用期間が長くなるほど骨折リスクの増加傾向が垣間見える。大腿骨頸部骨折は5年以上で統計的有意なリスク増加を示している。『高齢者の安全な薬物療法ガイドライン』のレビューには長期投与は骨折のリスクファクターではないという記載[13]があるが、2012年にBMJに掲載されたコホート研究(PMID:22294756)でもPPIの使用期間が長いとリスクが増加することが示されている。(図4)
そもそも、このガイドラインではPPIに関する記載はそれほど多くない。世界的には不適切処方が多いと指摘されているPPIではあるが、このガイドラインはあまり参考にならない。

(図4)PPIと骨折リスク
2011年のメタ分析[14]では、わずかではあるものの、骨折リスクが増加することが示されている。(相対危険1.30[95%信頼区間1.19~1.43])全体的に見てやはり、PPIでは骨折リスクがわずかに増加すると考えても良いかもしれない。なお、若年でもPPIで骨折リス増加を報告したコホート研究[15]がある。
[PPIと肺炎リスク]
PPIと肺炎リスクに関する研究報告は多い。2011年に報告されたメタ分析[16]ではPPIが肺炎リスクを有意に増加させるという結果になっている。ただ、研究間の異質性が非常に高い。つまり研究によってリスクが高いことが示されたり、むしろ低い傾向にあることが示されたり、一貫性がない。(図5)

(図5)PPIと肺炎リスク
PPIを使用している患者ではそもそも肺炎リスクが高いのではないか、という指摘もある。[17]PPIを投与する目的の一つに胃食道逆流症(GERD)の症状緩和があげられるが、こうした患者では、逆流した胃酸などが肺に侵入することで、気管支喘息や慢性閉塞性肺疾患、誤嚥性肺炎など様々な肺疾患を引き起こす可能性がある。GERDではそもそも、潜在的な肺炎発症リスクが高く、またPPIが既に使用されていることが多い可能性があるというわけだ。つまり観察的研究ではPPIで肺炎が起きているのか、GERDで肺炎が起きているのか明確に判別することは困難なのだ。
そんななか、興味深いメタ分析(PMID: 23856153)が報告された。この研究はGERDに対するPPIの使用を考慮するために、NSAIDs新規使用者を対象にしたコホート研究をメタ分析したものである(解析対象4,238,504人)。NSAIDsが使用されている患者では逆流性食道炎やGERDなどを合併している可能性が低いというわけだ。その結果、PPIの使用と市中肺炎リスクに関連性は見られなかった。(オッズ比1.05[95%信頼区間0.89~1.25](図6)

2015年に報告されたPPIと肺炎リスクの関連を検討したメタ分析[18]でもリスク増加を示している(1.49 [95% CI 1.16, 1.92])が、異質性を示すI2統計量は99.2%と高値であり、研究間で結果のばらつきが大きい。全体的にはリスクは増加傾向にあるかもしれないが、リスク不明とした研究も少なくないのだ。交絡因子の補正に関わる研究手法、また肺炎の診断手法によっても結果が変わってくるのかもしれない。総じてPPIの使用は、市中肺炎のリスクはわずかながら増加する可能性はあるものの、著明なリスク上昇とは言えない印象もある。
PPIでは、VB12の欠乏リスクやアミロイドβの産生促進が示唆されており、認知症の発症が増えるのではないかと考えられるが、2016年にドイツで行われたコホート研究[19]が報告されている。PPI使用者 (n = 2950; 平均 83.8歳 )では、PPIを使用していない人(n = 70,729 平均83.0歳に比べて有意に認知症リスクが増加した (ハザード比1.44 [95% CI, 1.36-1.52]).
2017年では台湾のコホート研究[20]が報告されている。PPI 使用者(n = 7863) はPPIを使用していない人(n = 7863) に比べて有意に認知症リスクが増加した(ハザード比1.22; [95%信頼区間 1.05-1.42]).
しかしながら、2016年に報告されている4研究のメタ分析[21]の結果では明確なリスク増加は示されておらず曖昧である。(図7)

さらに2017年6月に報告された観察研究[22]では、むしろ認知症リスク低下が示されている。(ハザード比0.78,[95%信頼区間0.66-0.93])つまるところ、現時点ではリスクが増加するか断定できない。
[PPIと消化管感染]
Clostridium difficile infectionは2012年のメタ分析[23]によればリスク増加を示している。(オッズ比1.65,95% CI (1.47, 1.85), I(2) = 89.9%)とはいえ、異質性高くそのリスクの程度にはバラつきがあるかもしれない。総じて感染症リスクは潜在的なリスクが大きく影響しているように思え、患者背景の考慮が肝要であろう。PPIと感染性胃腸炎のリスクにつてもリスク増加示した前向き研究[24]が報告されているが、特に慢性的な腸疾患を有する患者では注意が必要かもしれない。
[PPIと心血管リスク]
クロピドグレルとオメプラゾールは添付文書上,併用注意となっている。両剤の併用により一部の患者ではクロピドグレル活性代謝物の血中濃度が低下し、作用が減弱する可能性があるからだ。こうした相互作用が心血管リスクを増加させるかもしれないという仮説を検討した研究は多い。2010年に報告されたコホート研究[25]では、PPIとクロピドグレル併用で心血管リスクが増加したが、PPI単独でも増加しているという結果になっている。つまり、プロトンポンプ阻害剤は、心血管疾患の独立した危険因子かも知れない可能性が示唆されている。
実際、GERD患者では、PPIの使用で心筋梗塞が増える可能性を示唆したデータマイニング解析が報告されている。[26]
「PPIs to have a 1.16 fold increased association (95% CI 1.09-1.24) with myocardial infarction」
とはいえ、胃食道逆流症(GERD)患者ではそもそも、AMI発症リスクが高いという報告[27]がある。(ハザード比(HR)= 1.48; 95%信頼区間(CI):1.31-1.66、P <0.001)つまりPPI使用者の多くは、そもそも心筋梗塞発症リスクが高い集団であると言えるかもしれない。
またPPIを服用している人では、そもそも低用量アスピリンを服用している人が多い。つまりPPIを服用している人は潜在的に心血管イベントリスクが高い集団がかなり紛れ込んでいると言える。
[PPIと腎障害]
急性間質性腎炎はPPIに限らず多くの薬剤で起こり得る有害事象である。2015年に報告されたコホート研究[28]では、急性間質性腎炎を含む急性腎障害が有意に増加していることが示されている。特に急性間質性腎炎のリスク増加は大きくハザード比は3.00, 95% CI 1.47 to 6.14)となっている。2017年に報告された7つの観察研究のメタ分析[29]でも相対危険は1.61[95%信頼区間1.16~2.22]と有意に増加している。
AKIを繰り返し発症するとCKDに移行するかもしれない、という詩的がある。[30]2016年にはPPIとCKDの関連を見たコホート研究[31]が報告されている。研究対象となった10482人の平均年齢は63歳、男性は43.9%であった。PPI非使用者に比べて、PPI使用で慢性腎臓病リスクが増加した。人口統計、社会経済、臨床的要素で調整したハザード比[95%信頼区間]は1.50[1.14-1.96]であった。
PPIの有害事象として、CKDへの移行リスクを減らすためにもAKIの早期発見が重要かもしれない。しかし、急性間質性腎炎の症状に特異的なものはなく、様々な症状が出る可能性がる。(図8)

(図8)PPIによる急性間質性腎炎の症状
[PPIと死亡リスク]
PPIを使用していると死亡リスクが増加するかもしれないという衝撃の研究[32]が報告されている。(図9)
この研究では、消化器症状のない人での漫然使用が特にリスクが高いという結果になっており、やはり症状がないにもかかわらず、長期間投与され続けているPPIは中止を考慮した方が良いかも知れない。とはいえPPIの中止は消化器症状の再燃リスクが高いのもまた事実である。

(図9)PPIと死亡リスク
[PPIの中止]
突然PPIを中止するのと、段階的に中止するのを比較したランダム化比較試験[33]が報告されている。長期PPI使用患者97人が対象となり、1年後のPPI中止継続率が比較された。その結果、両群で中止継続率に有意差はないという結果になっている。
とはいえ、段階的に中止した方が、中止継続率は高い傾向にあり、高用量で投与されているケースでは、いきなり中止するよりは徐々に減らしていく方が良いかもしれない。ちなみにこの研究では、PPIの再開率はなんと73%と中止を継続できた人がかなり少ないことも示されている。
オンデマンド投与と定期的な投与を比較したコクランレビュー[34]では、消化管症状(例えば、消化不良、逆流)の増加をもたらすが、おそらくは服用量の減少させる可能性がある。とはいえ参加者の満足度は低下した。長期的な利益とPPI中止の害についての結論を下すためのデータは不十分であったと結論されている。
http://www.open-pharmacy-research.ca/wordpress/wp-content/uploads/ppi-deprescribing-algorithm-cc.pdf
PPIの継続を考慮すべき服薬理由として、(1)バレット食道がある場合、(2)出血リスクのある継続的なNSAIDs使用者、(3)重度の食道炎、(4)PPI中止により消化管出血を起こしたことのある人――が挙げられている。
[まとめ]
【有効性】PPIは強力な胃酸分泌抑制作用を有する
【低Mgリスク】特に利尿薬併用者では注意
【骨折リスク】特に長期投与で注意かも(若年でも懸念あり)
【認知症リスク】関連は曖昧で現時点では結論できない
【肺炎リスク】リスク上昇が懸念されるが不明な部分も多い
▶研究間の異質性高い。そもそもGERDが肺炎リスク
【感染性胃腸炎】慢性腸疾患を有する人では特に注意
【心血管リスク】不明な部分も多い
▶そもそもGERDが心血管リスク、アスピリンの服用
【AKI/CKD】非特異的な症状に注意、早期発見が大事かも
【PPI中止】症状の再燃に注意。漸減しながら経過観察
[参考文献]
[1] N Engl J Med. 1995 Oct 26;333(17):1106-10PMID: 7565948
[2] Int J Clin Pract. 2015 Oct;69(10):1088-111 PMID: 25846476
[3] PLoS One. 2015 Jul 6;10(7):e0131558PMID: 26147767
[4] Gastroenterology. 2016 Dec;151(6):1105-1112PMID: 27639805
[6] Eur J Intern Med. 2011;22(2): 205-210
[7] J Pediatr Gastroenterol Nutr. 2007;45(4): 421-427
[8] Pharm World Sci. 2006;28(4):189-193
[9] PLoS Med. 2014 Sep 30;11(9):e1001736. PMID: 25268962
[10] Am J Kidney Dis. 2015 Nov;66(5):775-82PMID: 26123862
[11] JAMA. 2013 Dec 11;310(22):2435-42. PMID: 24327038
[12] CMAJ. 2008 Aug 12;179(4):319-26. PMID: 18695179
[13] 確かにAm J Gastroenterol. 2011 Jul;106(7):1209-18では短期使用で有意増加するも長期使用では有意でないとする研究結果となっている。
[14] Am J Med. 2011 Jun;124(6):519-26. PMID: 21605729
[15] Osteoporos Int. 2015 Oct;26(10):2501-7. PMID: 25986385
[16] CMAJ. 2011 Feb 22;183(3):310-9PMID: 21173070
[17] Ann Thorac Med. 2009 Jul;4(3):115-23PMID: 19641641
[18] PLoS One. 2015 Jun 4;10(6):e0128004. PMID: 26042842
[19] JAMA Neurol. 2016 Apr;73(4):410-6PMID: 26882076
[20] PLoS One. 2017 Feb 15;12(2):e0171006 PMID: 28199356
[21] Ann Transl Med. 2016 Jun;4(12):240. PMID: 27429966
[22] J Am Geriatr Soc. 2017 Jun 7. doi: 10.1111/jgs.14956. [Epub ahead of print] PMID: 28590010
[23] PLoS One. 2012;7(12):e50836. PMID: 23236397
[24] PLoS One. 2016 Dec 20;11(12):e0168618PMID: 27997598
[25] Ann Intern Med. 2010 Sep 21;153(6):378-86PMID: 20855802
[26] PLoS One. 2015 Jun 10;10(6):e0124653. PMID: 26061035
[27] PLoS One. 2017 Mar 20;12(3):e0173899PMID: 28319162
[28] CMAJ Open. 2015 Apr 2;3(2):E166-71PMID: 26389094
[29] Drug Des Devel Ther. 2017 Apr 24;11:1291-1299. PMID: 28479851
[30] J Am Soc Nephrol. 2016 Aug;27(8):2393-406
[31] JAMA Intern Med. 2016 Feb;176(2):238-46PMID: 26752337
[32] BMJ Open 2017;7:e015735. doi: 10.1136/bmjopen-2016-015735
[33] Aliment Pharmacol Ther. 2006 Sep 15;24(6):945-54. PMID: 16948806
[34] Cochrane Database Syst Rev. 2017 Mar 16;3:CD011969. PMID: 28301676
※引用文献にない出典は本文中にPMIDとして記載してあります。